В корзине пусто!
- Телефоны
- Дилерский центр
КАТАЛОГ
КОРОТКИЕ ПЕПТИДЫ: РЕГУЛЯЦИЯ ФУНКЦИЙ КОЖИ ПРИ СТАРЕНИИ
В. Х. Хавинсон 1, 2, Н. С. Линькова 1, 3, А. С. Дятлова 1, Е. О. Гутоп 1, О. А. Орлова 1
1 Санкт-Петербургский институт биорегуляции и геронтологии, 197110, Санкт-Петербург, пр. Динамо, 3;
2 Институт физиологии им. И. П. Павлова, 199034, Санкт-Петербург, наб. Макарова, 6;
3 Академия постдипломного образования, 125371, Москва, Волоколамское шоссе, 91
Для поддержания функций кожи при старении применяют короткие пептиды, которые могут проникать через интактный роговой слой эпидермиса и оказывать влияние на клетки дермы. Короткие пептиды являются веществами, участвующими в естественных метаболических реакциях клеток, многие из них обладают геропротекторными свойствами. В обзоре рассмотрены основные группы пептидов-регуляторов функций фибробластов кожи: матрикины, карнозин, «коллагеновые» пептиды, аналоги факторов роста и цитокинов, дефенсины, иммунопротекторные пептиды и полифункциональные пептиды. Полифункциональные пептиды (AcSDKP, KED, AEDG, AED) обладают геропротекторными свойствами, замедляют апоптоз и стимулируют пролиферацию клеток кожи, повышают функциональную активность фибробластов кожи, нормализуют гомеостаз внеклеточного матрикса, являются антиоксидантами, иммунопротекторами, могут активировать микроциркуляцию в дерме. Пептидная регуляция функций кожи при старении является быстро развивающейся областью молекулярной геронтологии.
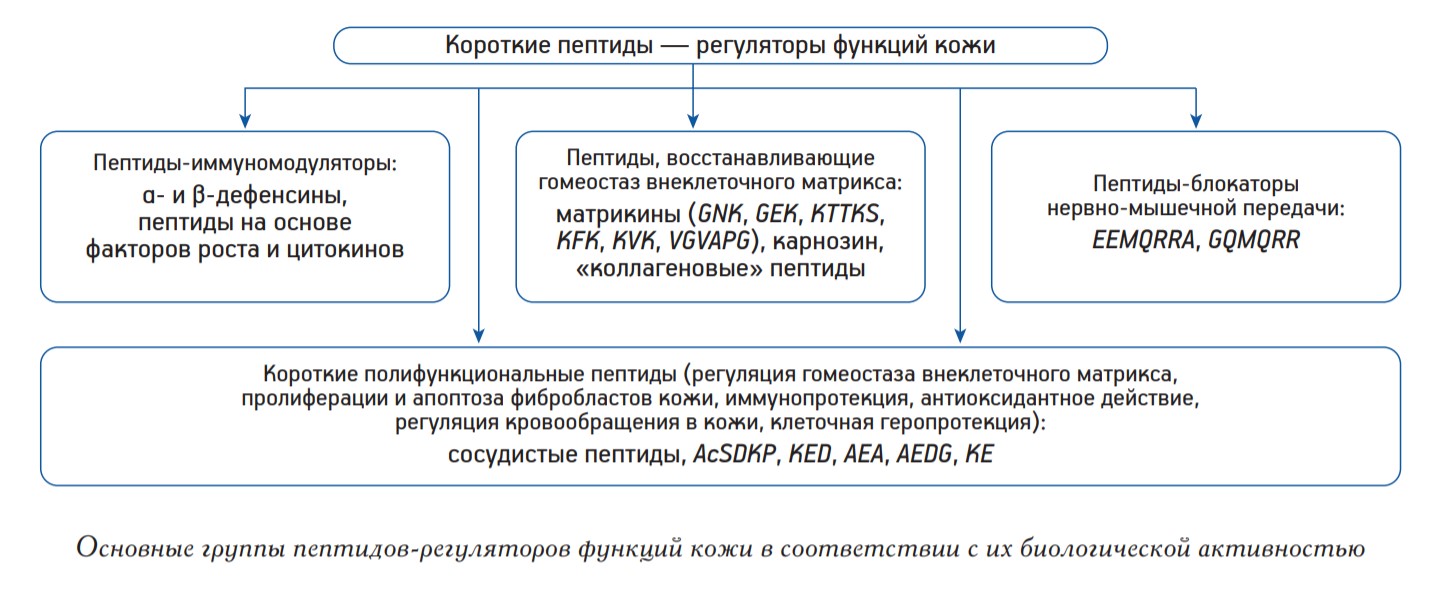
Старение кожи характеризуется выраженными внешними проявлениями — появлением морщин, потерей эластичности, гиперпигментацией. Эти возрастные изменения становятся заметны после 30 лет. Инволютивные изменения кожи связаны, главным образом, с деградацией внеклеточного матрикса (ВКМ), основными компонентами которого являются коллагены различных типов, эластин, гликозаминогликаны. С возрастом происходит снижение синтеза коллагена и гиалуроновой кислоты фибробластами, вследствие чего снижается упругость кожи и появляются морщины. Согласно одной из теорий старения кожи, ведущую роль в ее инволюции играет окислительный стресс и нарушение функции митохондрий, поэтому природные и синтетические антиоксиданты и витамины способствуют нормализации функций клеток кожи [4]. Вещества, повышающие функциональную активность фибробластов кожи при их старении, обладают рядом общих свойств. Они имеют небольшой размер (до 3 кДа), что позволяет проникать через барьер рогового слоя эпидермиса, по строению они сходны с веществами, участвующими в естественных метаболических реакциях клеток кожи, обладают способностью регулировать физиологический механизм обновления клеток кожи [10]. Среди веществ, обладающих такими свойствами, особый интерес для изучения представляют короткие биологически активные пептиды. Короткие пептиды способны проникать через интактный роговой слой кожи. Механизм действия таких пептидов может быть связан с их способностью связываться с внутриклеточными мишенями (ДНК, РНК, гистоновые белки) [7, 19] или рецепторами на мембране клеток [10, 21]. Пептиды-регуляторы функций клеток кожи по функциональной активности разделяют на активаторы синтеза компонентов ВКМ, иммуномодуляторы, блокаторы нервно-мышечной передачи и стимуляторы микроциркуляции [10].
Пептиды-активаторы синтеза внеклеточного матрикса.
К пептидам-стимуляторам синтеза компонентов ВКМ относят матрикины — короткие пептиды, открытые в процессе изучения механизмов заживления ран. Матрикины образуются при ферментативном гидролизе фрагментов белков ВКМ (коллагена, эластина, фибронектина) на стадии очищения ран перед их заживлением. Матрикины выполняют роль аутокринных и паракринных мессенджеров при ремоделировании ВКМ. Матрикины могут модулировать пролиферацию, миграцию и апоптоз клеток. Некоторые из них были идентифицированы как маркеры воспаления легких [22]. По данным литературы, матрикины в зависимости от структуры могут подавлять или стимулировать канцерогенез [45, 52]. Около 20 лет матрикины изучают в качестве веществ для замедления проявлений старения клеток кожи. Небольшой размер молекул позволяет матрикинам проникать через роговой слой кожи. В настоящее время в литературе описаны следующие матрикинподобные пептиды: GHK, GEKG, KTTKS, KFK, KVK, VGVAPG. Пептид GHK (Biopeptide CL, Trylagen, Aldenin) представляет собой матрикин, который может образовывать комплекс с медью и усиливает синтез компонентов ВКМ в коже. Пептид GHK может проникать в роговой слой и накапливаться в коже. При помощи иммуногистохимического метода продемонстрировано увеличение синтеза коллагена в коже после применения комплекса меди и GHK (Cu-GHK) в течение 1 мес [23]. При местном использовании средств с CuGHK отмечено повышение барьерных свойств кожи, уменьшение интенсивности воспалительных реакций, повышение скорости заживления ран, нормализация структуры дермального ВКМ [44]. Пептид GEKG (тетрапептид-21) в исследованиях in vitro увеличивает секрецию проколлагена и уровень мРНК коллагена в фибробластах кожи человека. В клиническом двойном слепом рандомизированном плацебо-контролируемом исследовании с участием 10 здоровых добровольцев старше 35 лет применение 1 раз в день в течение 8 нед пептида GEKG в концентрации 100 мг/ кг повышало экспрессию мРНК проколлагена 1-го типа в коже. Методом иммуногистохимии показано, что пептид GEKG повышает уровень проколлагена, гиалуроновой кислоты и фибронектина в коже [31, 53]. Пептид KTTKS представляет собой матрикин, полученный в результате протеолитического гидролиза коллагена. Этот пептид способствует синтезу компонентов ВКМ и увеличению экспрессии фибронектина и коллагена 1-го и 3-го типа фибробластами кожи человека in vitro [24]. Он также стабилизирует мРНК TGF-β, что может повышать синтез коллагена. Более стабильная пальмитоилированная форма KTTKS (Pal-KTTKS), также известная как Matrixyl, или пальмитоил пентапептид-3, способна проникать в роговой слой кожи и усиливать секрецию коллагена I типа фибробластами in vitro [39]. Модифицированный пептид Pal-KTTKS усиливает секрецию гиалуронсинтазы 1 фибробластами кожи человека in vitro.
Клинический результат применения пептида Pal-KTTKS оценивали в двойном слепом плацебо-контролируемом рандомизированном исследовании с участием 94 здоровых женщин, имеющих на лице морщины. Длину морщин оценивали по микрофотографиям с применением метода морфометрии. Кроме того, оценивали текстуру кожи, наличие пигментных пятен, темных кругов под глазами, используя шкалу от –4 (наихудшее) до +4 (наилучшее). После применения пептида Pal-KTTKS 2 раза в сут в течение 8 и 12 нед длина морщин статистически значимо снижалась. На 4-й неделе применения пептида улучшалась текстура кожи, уменьшалась выраженность пигментных пятен и темных кругов под глазами [50]. Исследования in vitro предполагают, что пептиды KTTKS и Pal-KTTKS увеличивают выработку коллагена, однако in vivo таких данных нам обнаружить не удалось. Матрикин KFK (Lypospondin) представляет собой короткий тромбосподин-подобный пептид, который, предположительно, активирует цитокин TGF-β и ингибирует активность матриксных металлопротеиназ (MMP). Установлено, что пептид KFK, конъюгированный с элаидиновой кислотой, повышал экспрессию TGF-β и тканевого ингибитора металлопротеиназ-1 (TIMP-1), ингибировал синтез MMP-2, MMP-9, MMP-3, MMP-1 в культурах фибробластов [28]. Более поздних работ по изучению механизма действия пептида KFK нами не было обнаружено. В 2017 г. было выявлено влияние матрикина KVK (Syn-Coll) на экспрессию коллагена и синтез меланина, а также на выраженность морщин и пигментации кожи. Добавление модифицированной формы пептида KVK (пальмитоилKVK-L-аскорбиновой кислоты, pal-KVK-AA) в концентрации 0,1–4,0 мкг/мл приводило к дозозависимому увеличению экспрессии коллагена в культурах фибробластах кожи человека. Добавление пептида pal-KVK-AA в концентрации 20 мкг/мл снижало концентрацию меланина в клетках меланомы B16F1В на 20 %. Через 8 и 12 нед после начала применения пептида pal-KVKAA наблюдали уменьшение шероховатости кожи, количества морщин и пигментации [42]. Матрикин VGVAPG является фрагментом эластина, обеспечивающим взаимодействие этого белка с эластин-связывающим белком (EBP) [26]. Пептиды с мотивом xGVxxG способны индуцировать синтез эластина фибробластами кожи. Установлено, что пептиды IGVAPG и VGVTAG стимулируют продукцию эластина в культурах дермальных фибробластов человека, взаимодействуя с EBP и регулируя активность инсулиноподобного фактора роста 1 (IGF-1). Эти пептиды индуцируют сигнальный путь, связанный с фосфорилированием рецептора инсулиноподобного фактора роста (IGF1R) и активацией синтеза тропоэластина [49]. Предполагается, что активацию IGF1R запускают два сигнальных пути. Первый путь индуцируется после прямого взаимодействия пептидов с рецептором эластина EBP. Белок EBP взаимодействует с рецептором, сопряженным с G-белком, что запускает активацию киназы c-Src и последующую (независимую от основного лиганда) перекрестную активацию соседних рецепторов IGF1R.
Другой путь заключается в том, что исследуемые короткие пептиды способны образовывать гидрофобные взаимодействия с VGVTAG, N-терминальным доменом сывороточного протеина IGFBP-1. Это вызывает конформационные изменения IGFBP-1 и высвобождение IGF-1, необходимого для последующей лиганд-специфической активации IGF1R. Описанная перекрестная активация IGF1R при помощи эластинподобных пептидов может являться альтернативой для улучшения состояния кожи с использованием IGF-1, который, несмотря на его геропротекторное действие [48], не рекомендуется для клинического изучения из-за побочных эффектов, в том числе стимуляции неопластических процессов [47]. Другим геропротекторным веществом, содержащим пептиды, является смесь антиоксиданта N-октаноил-карнозина, матрикинов GEKG и пальмитоил-GHK (MPC). В клиническом рандомизированном плацебо-контролируемом исследовании у женщин среднего и пожилого возраста применение МРС способствовало снижению выраженности периорбитальных морщин на 28 % через 1 мес, на 65 % — через 3 мес и на 81 % — через 6 мес применения. Одновременно при применении МРС в течение 6 мес на 59 % снижалась шероховатость кожи. При использовании МРС повышалась эластичность кожи по сравнению с исходным уровнем в среднем на 20 % на 2-й месяц, на 13 % — на 3-й и на 16 % — на 6-й месяц применения. Кроме того, применение МРС увеличивало упругость кожи на 11 % на 3-й месяц и на 22 % — на 6-й [29]. В состав MPC входит модифицированная молекула карнозина — дипептида, состоящего из аминокислотных остатков β-аланина и гистидина. Карнозин в высоких концентрациях обнаружен в мышцах и тканях мозга [34]. Карнозин участвует в синтезе мелатонина и улучшает функциональную активность клеток нейроиммуноэндокринной системы при возрастной патологии [37]. Кроме того, карнозин участвует в инактивации АФК и защищает организм от ненасыщенных альдегидов, образующихся из суперокисленных жирных кислот клеточных мембран в процессе окислительного стресса. Известно, что старение кожи сопровождается накоплением конечных продуктов гликирования (AGEs). При воздействии на кожу карнозина количество продуктов гликирования в коже снижалось примерно на 20–30 % [46]. Анализ публикаций, посвященных влиянию карнозина на количество конечных продуктов гликирования, показал, что он может предотвращать их образование. Вероятно, карнозин обладает антигликирующими свойствами и может препятствовать образованию белковых карбонилов и поперечных связей, вызванных восстановлением сахаров. Тем не менее, механизм, с помощью которого карнозин предотвращает образование AGEs, требует дальнейшего изучения [34]. Было изучено синтетическое средство на основе карнозина, экстракта фермента протеобактерий рода Altero monas, кросс-полимера гиалуроновой кислоты и трипептида — трифторацетата мочевины тетрадециламинобутироилвалиламиномасляной кислоты. Трипептид стимулировал эндогенный синтез гиалуроновой кислоты, протеогликанов и коллагена в фибробластах кожи [33]. К пептидам, регулирующим функции клеток кожи при старении, относятся также «collagen peptides» — продукты энзимолиза коллагена или желатина.
Большое количество работ посвящено изучению влияния таких пептидов на фотостарение кожи. Показано, что их пероральное применение улучшало гидратацию кожи, повышало эластичность и содержание коллагена в дерме [30, 34, 38, 54, 55]. Установлено, что пероральное применение коллагеновых пептидов не влияло на степень гидратации кожи мышей и содержание в ней гиалуроновой кислоты, но повышало упругость кожи, восстанавливало структуру коллагеновых волокон, повышало содержание коллагена и нормализовало соотношение коллагенов 1-го и 3-го типа при старении кожи. Кроме того, применение коллагеновых пептидов также повышало антиоксидантную активность ферментов кожи. В работе H. Song и соавт. было изучено влияние коллагеновых пептидов на содержание цитокинов в крови и коже 13-месячных мышей. После 2-х мес ежедневного введения коллагеновых пептидов оценивали изменение содержания 53 цитокинов в плазме и коже. Установлено, что ежедневное введение коллагеновых пептидов вызывало снижение содержания в коже цитокинов PIGF-2, IGFBP-2, IGFBP-3, PF4, серпина E1 и TGF-β1. Введение коллагеновых пептидов также приводило к повышению уровня мРНК коллагена 1-го типа и возрастанию количества коллагеновых волокон в коже 13-месячных мышей. В плазме крови было выявлено значительное снижение ряда цитокинов при введении коллагеновых пептидов по сравнению с контрольной группой, в частности, наблюдали снижение молекул FGF-2, HB-EGF, HGF, PDGF, VEGF, IL-2, IL-10. Кроме того, введение коллагеновых пептидов значительно снижало уровень показателей активации тромбоцитов в плазме, включая PF4, белок гранулярной мембраны GMP140, β-тромбоглобулин и серотонин. Эти результаты позволяют предположить механизм, лежащий в основе антивозрастного действия коллагеновых пептидов в отношении кожи, и подчеркивают потенциальную перспективу применения коллагеновых пептидов для борьбы с раком и сердечнососудистыми заболеваниями путем ингибирования активации тромбоцитов [56]. В литературе имеются данные о геропротекторных пептидах — фрагментах цитокинов и факторов роста. Аминокислотные последовательности этих пептидов не доступны в открытой печати, что затрудняет их сопоставление с другими пептидами и не позволяет в полной мере сделать заключение об их эффективности и механизме действия. Известно, что олигопептид-72 повышает пролиферацию фибробластов, активирует синтез коллагена, тормозит процессы деградации межклеточного вещества дермы, угнетая активность ММР и гиалуронидазы. Олигопептид-34 — структурный аналог ключевой последовательности фактора роста ТGF-β1. Подобно ТGF-β1, олигопептид-34 угнетает синтез меланина и передачу меланосом от меланоцитов кератиноцитам. Олигопептид-24 — аналог ключевой последовательности фактора роста EGF, обладающий способностью активировать рецепторы к EGF. Активация этих рецепторов повышает устойчивость клеток к фотоповреждению, снижает их апоптоз, стимулирует рост и миграцию клеток, а также синтез белков ВКМ. Олигопептид-24 уменьшает выраженность имеющихся морщин и предупреждает появление новых. Олигопептид-51 снижает синтез меланина меланоцитами и созревание меланосом, активирует пролиферацию кератиноцитов и фибробластов. Олигопептид-2 повышает барьерные свойства кожи и улучшает метаболическую активность фибробластов [3]. Показана эффективность комплекса пептидов (трипептид-41, нанопептид-18, олигопептид-61, олигопептид-73) при лечении грыжи век — протрузии интраорбитальной жировой клетчатки с выпячиванием ослабленной и растянутой передней стенки [2].
Пептиды-иммуномодуляторы.
Для восстановления функций фибробластов кожи при старении изучаются пептиды иммуномодуляторы. К таковым относят, например, α- и β-дефенсины. Их размер составляет 18–25 аминокислотных остатков, а основная функция заключается в уничтожении бактерий, поглощенных при фагоцитозе [51]. Было показано, что дефенсины активируют LGR6-положительный локус стволовых клеток, которые определяются как источник большинства новых эпидермальных клеток во время заживления ран. У женщин среднего и пожилого возраста применение дефенсинов приводило к статистически значимому уменьшению пор, выраженности поверхностных морщин, жирности и пигментации кожи по сравнению с группой, применявшей плацебо. Авторы полагают, что применение дефенсинов активирует дифференцировку стволовых клеток в эпидермальном направлении [57]. Описан пептид Bodyfensin (acetyl-arginylphenylglycyl-phenylglycine), активирующий синтез β-дефенсинов человека, что приводит к усилению барьерной функции кожи. Показано, что олигопептид-34 проявляет противовоспалительные свойства и снижает пролиферацию активных Т-клеток в коже [3].
Пептиды-блокаторы нейромышечной передачи.
Механизм действия пептидов-блокаторов нейромышечной передачи аналогичен механизму инъекций ботулотоксина, но в более мягкой форме. К таким пептидам относится GQMQRR (Argireline; Acetil hexapeptide-8) [12]. Цитотоксичность пептида GQMQRR в отношении линий клеток HEK-293, IMR-32 нейробластомы и первичных фибробластов кожи человека наблюдали при концентрациях в 18–10 000 раз более высоких по сравнению с доксорубицином [35]. Механизм действия GQMQRR заключается в том, что он конкурирует с SNAP-25 за связывание с мембранным белком, ассоциированным с везикулами (VAMP). Это дестабилизирует образование тройного растворимого комплекса SNARE и приводит к ингибированию нейронального экзоцитоза. В результате, пептид GQMQRR ингибирует высвобождение ацетилхолина [27] и уменьшает повторяющиеся сокращения мышц лица, снижая выраженность мимических морщин [58]. Аналогичным механизмом действия обладают пептиды EEMQRRA и EEMQRRAD. Однако была выявлена низкая проницаемость кожи для пептида GQMQRR вследствие большой молекулярной массы и гидрофильности [43]. В 2018 г. S. H. Lim и соавт. была опубликована работа об изучении миметиков ботокса — аргирелина (Arg0, GQMQRR) и его аналогов (Arg1, Arg2, Arg3). Ранее было продемонстрировано, что Arg0 безопаснее ботокса и также эффективен в борьбе с морщинами (эффективность до 48 % после 4 нед приема 2 раза в день). Структурно Arg0 представляет собой синтетический ацетилгексапептид, механизм действия которого заключается в ингибировании высвобождения ацетилхолина и уменьшении сокращений внутренних мышц лица. Однако Arg0 обладает большой молекулярной массой и гидрофильностью, вследствие чего его проницаемость в кожу низкая. Также существенную роль играет тот факт, что Arg0 существует в цвиттер-ионной форме, и это заряженное состояние препятствует проникновению через кожу. Авторы утверждают, что химическая модификация пептидной структуры Arg0 для уменьшения образования цвиттер-ионов может привести к увеличению проницаемости кожи для этой молекулы. В исследовании изучали все четыре пептида (Arg0, Arg1, Arg2, Arg3), отличающиеся липофильностью и молекулярной массой, и сравнивали их способность проникать через кожу, а также их эффективность in vitro на культурах нейрональных клеток. Было выяснено, что химические модификации Arg2, Arg3, несмотря на большую, чем у Arg0, молекулярную массу, демонстрировали лучшее проникновение через кожу (в 2,2–2,5 раза) в течение 24 ч по сравнению с Arg0. В случае модификации Arg1 тенденция была обратной. Растворителем пептидов был выбран пропиленгликоль, и было продемонстрировано, что различная концентрация пропиленгликоля оказывает неодинаковый эффект на проникновение пептидов в кожу. Наибольшее проникновение в кожу пептида Arg0 наблюдали при концентрации пропиленгликоля 70 %, для пептидов Arg1, Arg2, Arg3 концентрация пропиленгликоля составила 100 % при наиболее эффективном проникновении в кожу. Arg0 продемонстрировал снижение высвобождения глутамата на 13 % по сравнению с контролем. Аналогичная эффективность была продемонстрирована в Arg1 с уменьшением высвобождения глутамата на 14 % по сравнению с контролем. Хотя модификация Arg2 демонстрировала высокие показатели проникновения через кожу, для нее была продемонстрирована относительно небольшая эффективность с уменьшением высвобождения глутамата всего на 4 % по сравнению с контролем. Наибольшая эффективность ингибирования выделения глутамата in vitro по сравнению с контролем была продемонстрирована модификацией Arg3 (43 %) [43].
Полифункциональные пептиды.
Помимо пептидов, действующих только на один из компонентов функционирования кожи, можно выделить и полифункциональные короткие пептиды. К ним относятся пептиды — регуляторы микроциркуляции ди-, три- и тетрапептиды, разработанные в Санкт-Петербургском институте биорегуляции и геронтологии: AEDG, KED, KE, AED [16]. Пептид AEDG, входящий в состав полипептидного комплекса эпифиза [16, 20], обладает антиоксидантной и иммуностимулирующей активностью, способствует увеличению длины теломер фибробластов [25, 40]. Установлено, что пептид AEDG стимулирует рост фибробластов кожи в культуре, были выявлены некоторые молекулярные аспекты этого эффекта. Так, при старении фибробластов кожи экспрессия проапоптозных белков p53, р16, сaspase-3 повышается. При старении в дермальных фибробластах под действием пептида AEDG экспрессия белков p53, сaspase-3 и р16 снижается. Кроме того, в «старых» культурах фибробластов кожи под действием пептида AEDG повышается экспрессия белков CD98hc, MMP-9 и Ki67. Таким образом, пептид AEDG активирует пролиферацию и функциональную активность фибробластов кожи при их старении, одновременно снижая выраженность апоптоза этих клеток [9]. В сочетании с иммуностимулирующим эффектом этого пептида, он может оказывать комплексное протекторное действие на функцию кожи при ее старении. Сходными эффектами на экспрессию сигнальных молекул в фибробластах кожи при их старении in vitro обладали пептиды KED, KE, AED [9]. Пептид KED обладает вазопротекторным эффектом, нормализуя функции эндотелия сосудов при старении, нарушениях микроциркуляции и атеросклерозе [5, 14, 17, 18], а также обладает иммуностимулирующим свойством [41]. Пептид KED способствует более быстрой эпителизации ран у крыс, что указывает на его протекторное действие в отношении кожи. Кроме того, применение этого пептида показало его эффективность у пациенток старше 55 лет [1]. Пептид KE, входящий в состав лекарственного препарата «Тималин», активирует пролиферацию и дифференцировку эпителиальных и иммунных клеток тимуса [8]. В экспериментах на животных пептид KE способствует заживлению ран. В культурах фибробластов кожи при их старении in vitro пептид KE повышает экспрессию коллагена 1-го типа и белка «молодости» сиртуина-6 [13]. Пептид AED в экспериментах на животных регулировал метаболизм соединительной ткани, что указывает на его хондропротекторные свойства [15]. Пептиды AEDG, KED, KE, AED имеют ряд важных общих свойств: все они обладают антиоксидантным свойством, в многолетних исследованиях показана их безопасность, отсутствие иммуногенности и других побочных эффектов [6, 11]. В работе N. Hajem и соавт. описан тетрапептид ацетил-N-Ser-Asp-Lys-Pro (AcSDKP), встречающийся в природе и являющийся ангиогенным фактором. Авторы утверждают, что, помимо ангиогенных свойств, AcSDKP также способствует восстановлению повреждений кожи и замедляет процесс старения кожи. In vitro AcSDKP в концентрациях 10–11–10–7 М стимулировал пролиферацию кератиноцитов и фибробластов человека. Кроме того, AcSDKP усиливал рост клеток-предшественников эпидермальных кератиноцитов и стволовых клеток. Местное применение 10 мкМ AcSDKP, изученное ex vivo с помощью кожных эксплантатов, увеличивало толщину эпидермиса и усиливало синтез кератинов 14 и 19, фибронектина, коллагена 3-го и 4-го типа, а также гликозаминогликанов (GAG). В культивированных волосяных фолликулах AcSDKP способствовал удлинению стержня волоса и вызывал морфологические и молекулярные модификации, соответствующие критериям роста волос. Кроме того, было показано, что AcSDKP в концентрациях 10– 11– 10–7 М улучшает эпидермальный барьер, стимулируя экспрессию белков плотных контактов — клаудина-1, окклюдина и ZO-1, играющих важную роль в соединении соседних клеток. Этот тетрапептид также активировал SIRT1, участвующий в контроле жизнеспособности клеток. В присутствии AcSDKP в концентрациях 10–11–10–7 М наблюдали двукратное увеличение синтеза SIRT1 культивируемыми кератиноцитами [36]. Аналогичные результаты получены в работе Y. Fromes и соавт. Авторы исследовали способность AcSDKP стимулировать восстановление кожных повреждений при помощи моделей лоскутов кожи спины и брюшной полости крыс. Послеоперационные подкожные инъекции AcSDKP (5 мкг/кг 2 раза в день в течение 3 дней после подъема лоскута) предотвращали некроз перфузированных областей. Средняя площадь выживаемости кожи брюшных и спинных лоскутов варьировала от 50,9±19,3 и 53,4±4,2 % в контрольных группах до 66,4±7,5 и 74,7±6,6 % в группах, получавших AcSDKP. Кроме того, в анализе ex vivo AcSDKP, нанесенный локально на эксплантаты кожи в дозах 10–8–10–5М, улучшал выживаемость эксплантированной кожи, подвергшейся облучению ультрафиолетом типа B. После местного применения AcSDKP наблюдали повышенную реэпителизацию, а также более высокий уровень экспрессии базального кератина 14 и повышенную экспрессию фибронектина. Таким образом, эти данные идентифицируют AcSDKP как агент для восстановления тканей и предполагают его потенциальное клиническое использование для лечения кожных ран [32].
Заключение.
К пептидам относится группа веществ, способных повышать функциональную активность клеток кожи при старении in vitro и in vivo. Это объяснятся небольшим размером молекул, позволяющим преодолевать кожный барьер, а также их влиянием на компоненты ВКМ, фибробласты кожи, иммуномодулирующими и антиоксидантными свойствами. Проанализировав имеющиеся в литературе данные, можно предложить следующее разделение пептидов-регуляторов функций кожи по функциональным группам (рисунок). Стоит отметить, что для многих пептидов, восстанавливающих функции клеток кожи при старении, не описан молекулярный механизм действия, а имеются только визуальные наблюдения за состоянием кожи в эксперименте. Важным является и тот факт, что многие модифицированные пептиды, обладающие протекторными свойствами в отношении кожи, при увеличении концентрации могут оказывать токсические эффекты, что требует более детального изучения. Несмотря на это, существуют и более подробные исследования немодифицированных пептидов, не обладающих побочными эффектами, для которых в литературе приведены сведения о молекулярных механизмах их биологической активности. Таким образом, пептидная регуляция функций кожи при старении является перспективным, быстро развивающимся направлением молекулярной геронтологии. Конфликт интересов отсутствует.
Литература
1. Борзова И. В., Арутюнов В. А., Козина Л. С., Рыжак Г. А. Коррекция нарушений оксидативного метаболизма в коже мышей различного возраста с помощью пептиднобиоантиоксидантного комплекса // Науч. ведомости Белгород. гос. ун-та (серия «Медицина. Фармация»). 2012. № 22–2 (141). С. 14–18.
2. Газитаева З., Забненкова О. Инъекционная блефаропластика Caregen // Эстет. мед. 2014. Т. XIII. № 3. С. 395–404. 3. Газитаева
З. И., Чеонг Й., Линькова Н. С. и др. Молекулярная морфология кожи. Оптимизация диагностики старения и изучения пептидных геропротекторов. СПб.: Свое издательство, 2015.
4. Калинченко С. Ю., Гусакова Д. А., Ворслов Л. О. и др. Окислительный стресс и старение. Роль витамина D в генезе ассоциированных с возрастом заболеваний // Эффективная фармакотер. 2016. № 2. С. 8–14.
5. Китачёв К. В., Сазонов А. Б., Козлов К. Л. и др. Роль вазоактивного пептида в лечении хронической артериальной недостаточности нижних конечностей // Успехи геронтол. 2013. Т. 26. № 2. С. 292–296.
6. Козина Л. С., Стволинский С. Л., Федорова Т. Н. и др. Изучение антиоксидантных и мембранопротекторных свойств коротких пептидов в модельных экспериментах. // Вопр. биол., мед. и фармацевтической химии. 2008. № 6. С. 31–36.
7. Кузник Б. И., Давыдов С. О., Поправка Е. С. и др. Эпигенетические механизмы пептидной регуляции и нейропротекторный белок FKBP1b // Молекул. биол. 2019. Т. 53. №2. С. 339–348.
8. Линькова Н. С., Полякова В. О., Трофимов А. В. и др. Пептидергическая регуляция дифференцировки, пролиферации и апоптоза тимоцитов при старении вилочковой железы // Бюл. экспер. биол. 2011. Т. 151. № 2. С. 203–206.
9. Линькова Н. С., Дробинцева А. О., Орлова О. А. и др. Пептидная регуляция функций фибробластов кожи при их старении in vitro // Клеточные технол. в биол. и мед. 2016. № 1. C. 40–44.
10. Орасмяэ-Медер Т., Эрнандес Е. Пептидные технологии в косметике: тенденции и перспективы // Косметика & медицина. 2010. № 2. С. 46–53.
11. Орлова О. А., Линькова Н. С., Трофимова C.В., Хавинсон В. Х. Общие теории старения и частный случай: анализ старения кожи и достижения современной косметологии // Геронтология. 2017. Т. 5. № 1. С. 10–30.
12. Фридман Н. В., Фетисова Н. В. Обзор пептидов, применяемых в дерматокосметологии // Успехи геронтол. 2015. Т. 28. № 4. С. 769–774.
13. Фридман Н. В., Линькова Н. С., Полякова В. О. и др. Молекулярные аспекты геропротекторного действия пептида КЕ в культуре фибробластов кожи человека // Успехи геронтол. 2017. Т. 30. № 5. С. 698–702.
14. Хавинсон В. Х., Григорьев Е. И., Малинин В. В., Рыжак Г. А. Пептид, повышающий резистентность капилляров, фармацевтическая композиция на его основе, и способ ее применения: патент РФ №2295970, 2006.
15. Хавинсон В. Х., Григорьев Е. И., Малинин В. В., Рыжак Г. А. Пептид, нормализующий метаболизм в костной и хрящевой тканях, фармацевтическая композиция на его основе и способ ее применения: патент РФ № 2299741, 2006.
16. Хавинсон В. Х. Пептидная регуляция старения. СПб.: Наука, 2010.
17. Хавинсон В. Х., Линькова Н. С., Елашкина Е. В. и др. Молекулярные аспекты антиатеросклеротического действия коротких пептидов // Клеточные технол. в биол. и мед. 2014. №3. С. 185–189.
18. Хавинсон В. Х., Тарновская С. И., Линькова Н. С. и др. Эпигенетические аспекты пептидной регуляции пролиферации эндотелия сосудов при его старении// Успехи геронтол. 2014. Т. 27. № 1. С. 108–114.
19. Хавинсон В. Х., Линькова Н. С., Тарновская С. И. Короткие пептиды регулируют экспрессию генов // Бюл. экспер. биол. 2016. Т. 162. № 8. С. 259–263.
20. Хавинсон В. Х., Копылов А. Т., Васьковский Б. В. и др. Идентификация пептида AEDG в полипептидном комплексе эпифиза // Бюл. экспер. биол. 2017. Т. 164. № 7. С. 52–55.
21. Шпаков А. О., Шпакова Е. А. Перспективы применения в медицине пептидов и их производных, структурно соответствующих сопряженным с G-белками рецепторам // Биомед. химия. 2015. Т. 61. № 1. С. 19–29.
22. Abdul Roda M., Fernstrand A. M., Redegeld F. A. et al. The matrikine PGP as a potential biomarker in COPD // Amer. J. Physiol. Lung. Cell molec. Physiol. 2015. Vol. 308. P. L1095– L1101.
23. Abdulghani A. A., Sherr A., Shirin S. et al. Effects of topical creams containing vitamin C, a copper-binding peptide cream and melatonin compared with tretinoin on the ultrastructure of normal skin – a pilot clinical, histologic, and ultrastructural study // Dis. Manag. clin. Outcome. 1998. Vol. 1. P. 136–141.
24. Abu Samah N. H., Heard C. M. Topically applied KTTKS: a review // Int. J. Cosmet. Sci. 2011. Vol. 33. P. 483–490.
25. Anisimov V. N., Khavinson V. Kh. Peptide bioregulation of aging: results and prospects // Biogerontology. 2010. № 11. P. 139–149.
26. Blanchevoye C., Floquet N., Scandolera A. et al. Interaction between the elastin peptide VGVAPG and human elastin binding protein // J. biol. Chem. 2013. Vol. 288. P. 1317–1328.
27. Blanes-Mira C., Clemente J., Jodas G. et al. A synthetic hexapeptide (Argireline) with antiwrinkle activity // Int. J. Cosmetic Sci. 2002. Vol. 24. P. 303–310.
28. Cauchard J.-H., Berton A., Godeau G. et al. Activation of latent transforming growth factor beta 1 and inhibition of matrix metalloprotease activity by a thrombospondin-like tripeptide linked to elaidic acid // Biochem. Pharmacol. Vol. 67. P. 2013–2022.
29. Dreher F. A. Novel Matrikine-Like Micro-Protein Complex (MPC) Technology for Topical Skin Rejuvenation // J. Drugs. Dermat. 2016. Vol. 15. P. 457–464.
30. Fan J., Zhuang Y., Li B. Effects of collagen and collagen hydrolysate from jellyfi sh umbrella on histological and immunity changes of mice photoaging // Nutrients. 2013. Vol. 5. P. 223–233.
31. Farwick M., Grether-Beck S., Marini A. et al. Bioactive tetrapeptide GEKG boosts extracellular matrix formation: in vitro and in vivo molecular and clinical proof // Exp. Dermatol. 2011. Vol. 20. P. 602–604.
32. Fromes Y., Liu J. M., Kovacevic M. et al. The tetrapeptide acetyl-serine-aspartyl-lysine-proline improves skin fl ap survival and accelerates wound healing // Wound. Repair. Regen. 2006. Vol. 14. P. 306–312.
33. Garre A., Martinez-Masana G., Piquero-Casals J., Granger C. Redefi ning face contour with a novel anti-aging cosmetic product: an open-label, prospective clinical study // Clin. Cosmet. Inv. Dermat. 2017. № 10. P. 473–482.
34. Ghodsi R., Kheirouri S. Carnosine and advanced glycation end products: a systematic review // Amino Acids. 2018. Vol. 50. P. 1177–1186.
35. Grosicki M., Latacz G., Szopa A. et al. The study of cellular cytotoxicity of argireline — an anti-aging peptide // Acta Biochim. Polon. 2014. Vol. 61. P. 29–32.
36. Hajem N., Chapelle A., Bignon J. et al. The regulatory role of the tetrapeptide AcSDKP in skin and hair physiology and the prevention of ageing effects in these tissues — A potential cosmetic role // Int. J. Cosmet. Sci. 2013. Vol. 35. P. 286–298.
37. Hipkiss A. R. Energy metabolism, proteotoxic stress and age-related dysfunction — protection by carnosine // Molec. Aspects Med. 2011. Vol. 32. P. 267–278.
38. Hou H., Li B., Zhang Z. et al. Moisture absorption and retention properties, and activity in alleviating skin photodamage of collagen polypeptide from marine fi sh skin // Food Chem. 2012. Vol. 135. P. 1432–1439.
39. Jones R. R., Castelletto V., Connon C. J., Hamley I. W. Collagen stimulating effect of peptide amphiphile C16-KTTKS on human fi broblasts // Molec. Pharm. 2013. Vol. 10. P. 1063– 1069.
40. Khavinson V. Kh., Bondarev I. E., Butyugov A. A., Smirnova T. D. Peptide Promotes Overcoming of the Division Limit in Human Somatic Cell // Bul. exp. Biol. Med. 2004. Vol. 137. № 5. P. 613–616.
41. Khavinson V. Kh., Polyakova V. O., Linkova N. S. et al. Peptides Regulate Cortical Thymocytes Differentiation, Proliferation, and Apoptosis // J. Amino Acids. 2011. Vol. 2011. Article ID 517137.
42. Kim H. M., An H. S., Bae J.-S., et al. Effects of palmitoylKVK-L-ascorbic acid on skin wrinkles and pigmentation // Arch. Dermat. Res. 2017. Vol. 309. P. 397–402.
43. Lim S. H., Sun Y., Thiruvallur Madanagopal T. et al. Enhanced Skin Permeation of Anti-wrinkle Peptides via Molecular Modifi cation // Sci. Reports. 2018. Vol. 8. P. 1596.
44. Mazurowska L., Mojski M. Biological activities of selected peptides: skin penetration ability of copper complexes with peptides // J. Cosmet. Sci. 2008. Vol. 59. P. 59–69.
45. Monboisse J. C., Oudart J. B., Ramont L., et al. Matrikines from basement membrane collagens: a new anti-cancer strategy // Biochim. Biophys. Acta. 2014. Vol. 1840. P. 2589–2598.
46. Narda M., Peno-Mazzarino L., Krutmann J. et al. Novel Facial Cream Containing Carnosine Inhibits Formation of Advanced Glycation End-Products in Human Skin // Skin Pharm. Physiol. 2018. Vol. 31. P. 324–331.
47. Pollak M. The insulin and insulin-like growth factor receptor family in neoplasia: an update // Nature Rev. Cancer. 2012. Vol. 12. P. 159–169.
48. Puche J. E., Castilla-Cortázar I. Human conditions of insulin-like growth factor-I (IGF-I) defi ciency // J. Translat. Med. 2012. Vol. 10. P. 224.
49. Qa’aty N., Vincent M., Wang Y. et al. Synthetic ligands of the elastin receptor induce elastogenesis in human dermal fi - broblasts via activation of their IGF-1 receptors // J. Dermat. Sci. 2015. Vol. 80. № 3. P. 175–185.
50. Robinson L. R., Fitzgerald N. C., Doughty D. G. et al. Topical palmitoyl pentapeptide provides improvement in photoaged human facial skin // Int. J. Cosmet. Sci. 2005. Vol. 27. P. 155–160.
51. Shafee T. M., Lay F. T., Phan T. K. et al. Convergent evolution of defensin sequence, structure and function // Cell molec. Life Sci. 2017. Vol. 74. P. 663–682.
52. Sivaraman K., Shanthi C. Matrikines for therapeutic and biomedical applications // Send to Life Sci. 2018. Vol. 214. P. 22– 33.
53. Sommer E., Neubert R. H.H., Mentel M. et al. Dermal peptide delivery using enhancer molecules and colloidal carrier systems. Part III: Tetrapeptide GEKG // Europ. J. Pharm. Sci. 2018. Vol. 124. P. 137–144.
54. Song H., Meng M., Cheng X. et al. The effect of collagen hydrolysates from silver carp (Hypophthalmichthys molitrix) skin on UV-induced photoaging in mice: molecular weight affects skin repair // Food Funct. 2017. Vol. 8. P. 1538–1546.
55. Song H., Zhang S., Zhang L., Li B. Effect of Orally Administered Collagen Peptides from Bovine Bone on Skin Aging in Chronologically Aged Mice // Nutrients. 2017. Vol. 9. pii: E1209.
56. Song H., Zhang L., Luo Y. et al. Effects of collagen peptides intake on skin ageing and platelet release in chronologically aged mice revealed by cytokine array analysis // J. Cell molec. Med. 2018. Vol. 22. P. 277–288.
57. Taub A., Bucay V., Keller G. et al. Multi-Center, Double-Blind, Vehicle-Controlled Clinical Trial of an Alpha and Beta Defensin-Containing Anti-Aging Skin Care Regimen With Clinical, Histopathologic, Immunohistochemical, Photographic, and Ultrasound Evaluation // J. Drugs Dermat. 2018. Vol. 17. P. 426–441.
58. Yamauchi P. S., Lowe N. J. Botulinum toxin types A and B: comparison of effi cacy, duration, and dose-ranging studies for the treatment of facial rhytides and hyperhidr